
DLL3靶点
靶点背景
1. CD19靶点基本信息
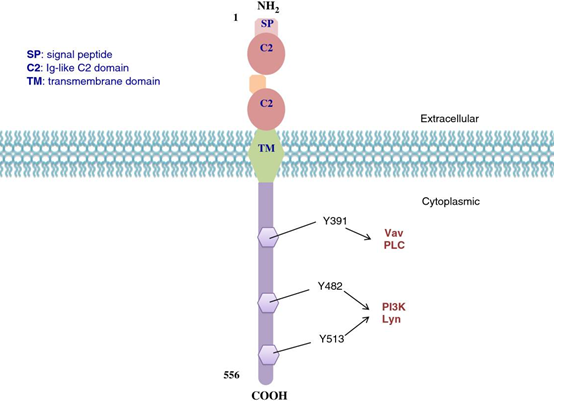
定位:一种 95 kDa的I型跨膜糖蛋白。
表达谱: 特异性表达于B淋巴细胞的各个发育阶段(从早前B细胞到成熟B细胞,直至分化为浆细胞前),但在造血干细胞、浆细胞或其他正常组织细胞中不表达。
功能: 是B细胞受体信号复合物的关键共刺激分子。它与CD21、CD81等形成复合物,降低B细胞激活阈值,对B细胞的增殖、分化和信号传导至关重要。
2. 作为药物靶点的潜力:
高特异性: 仅限B细胞谱系表达,靶向治疗对T细胞、干细胞等其他细胞影响小。
高密度表达: 在B细胞恶性肿瘤细胞表面通常呈现高密度、均匀、稳定的表达。
不内化: 与抗体结合后内化效率低,有利于抗体或CAR-T细胞持续作用。
关键生存信号: 对恶性B细胞的存活和增殖有重要作用,靶向它能产生直接杀伤效应。
2. 靶向CD19的药物类型与研发进展
主要分为三大类:单克隆抗体、抗体药物偶联物、CAR-T细胞疗法。
1. 单克隆抗体
机制: 通过抗体依赖的细胞介导的细胞毒作用、补体依赖的细胞毒作用和直接诱导凋亡来杀伤B细胞。
代表药物: Blinatumomab(博纳吐单抗)
结构: 一种双特异性T细胞衔接器。一端结合CD19(B细胞),另一端结合CD3(T细胞),将T细胞重定向至肿瘤细胞,激活T细胞进行杀伤。
适应症: 主要用于治疗复发/难治性前体B细胞急性淋巴细胞白血病,以及微小残留病灶阳性的B-ALL。
特点: 是首个获批的BiTE平台药物,需连续静脉输注,但为ALL患者提供了无化疗的选择。
2. 抗体药物偶联物
机制: 抗体靶向递送细胞毒性药物至表达CD19的肿瘤细胞。
代表药物: Loncastuximab Tesirine(商品名:Zynlonta)
结构: 抗CD19单抗连接吡咯并苯并二氮杂卓二聚体弹头。
适应症: 用于治疗复发/难治性弥漫大B细胞淋巴瘤(至少接受过两种全身疗法)。
特点:首个获批的靶向CD19的ADC,为DLBCL患者提供了重要的后线治疗选择。
3. CAR-T细胞疗法
机制: 采集患者自身T细胞,在体外通过基因工程改造,使其表达针对CD19的嵌合抗原受体,然后回输患者体内,从而特异性识别并清除CD19阳性肿瘤细胞。
已获批的代表产品(截至2024年):
Yescarta(Axicabtagene Ciloleucel): 首个获批用于DLBCL的CAR-T产品。
Kymriah(Tisagenlecleucel): 首个获批的CAR-T产品,用于ALL和DLBCL。
Tecartus(Brexucabtagene Autoleucel): 用于套细胞淋巴瘤和ALL。
Breyanzi(Lisocabtagene Maraleucel): 用于DLBCL等。
Relma-cel(瑞基奥仑赛,中国自主研发): 在中国获批用于DLBCL。
4. 面临主要挑战
复发问题: 约30%-50%的患者在接受CAR-T治疗后仍会复发。主要原因包括:
抗原逃逸: 肿瘤细胞通过CD19表达下调、丢失或截短变异(如CD19阴性复发)来逃避识别。
CAR-T细胞持久性不足: 体内存活时间短,无法形成长期免疫监视。
免疫抑制性微环境: 肿瘤微环境抑制CAR-T细胞功能。
毒性:
细胞因子释放综合征: 免疫过度激活引起的全身性炎症反应。
免疫效应细胞相关神经毒性综合征:可能危及生命的神经系统毒性。
5. 研发前沿与策略
双靶点/多靶点CAR-T: 开发同时靶向CD19和另一个B细胞抗原(如CD20、CD22)的CAR-T,以克服抗原逃逸。CD19/CD22双靶点CAR-T已进入临床,显示出良好前景。
装甲CAR: 共表达细胞因子(如IL-15)或抗免疫抑制分子,以增强持久性和抵抗微环境抑制。
联合疗法: CAR-T与免疫调节剂、小分子靶向药(如BTK抑制剂伊布替尼)等联合,旨在改善微环境、增强疗效。
扩展适应症:通过清除产生自身抗体的B细胞,治疗B细胞介导的自身免疫病,已取得突破性早期临床结果。
CD19作为一个优秀的B细胞标志物,已催生了从单抗、ADC到革命性CAR-T细胞疗法的一系列成功药物,彻底改变了B细胞恶性肿瘤的治疗格局。CAR-T疗法更是开启了肿瘤免疫治疗的新时代。
项目名称
CD19特异性单克隆抗体
项目亮点
合作模式
序列授权
合作开发
数据展示
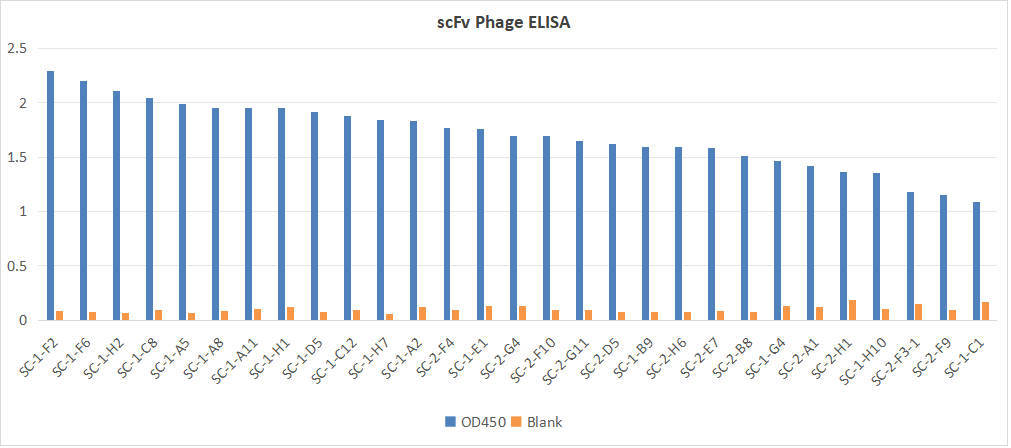
本项目目前筛选到scFv类型分子。部分数据如下:
总结分析
该项目共现筛选出多种特异性结合分子共20+序列。
更多分子类型抗体及检测数据进一步深入开发中。