
DLL3靶点
靶点背景
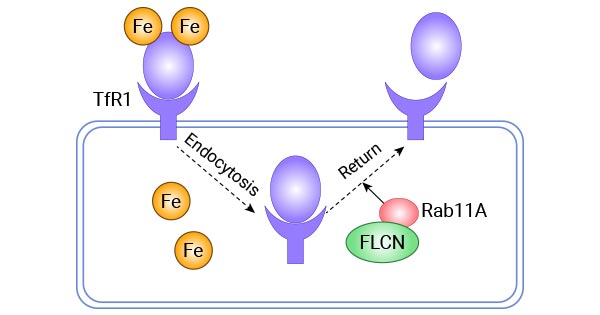
TFR1(转铁蛋白受体1)是一个在细胞铁摄取中扮演核心角色的跨膜蛋白。在快速增殖细胞(如癌细胞)中的显著高表达。
全称: Transferrin Receptor 1
常用名称: TFR1, TR, CD71 (在免疫学中常用此命名)
基因名称: TFRC (Transferrin Receptor Gene)
基因位置: 人类染色体 3q29
蛋白结构: II型跨膜蛋白,以同源二聚体形式存在。每个单体包含:
胞外区: 负责与转铁蛋白结合。
跨膜区: 锚定在细胞膜上。
胞内区: 一个短的N端尾部,包含内化信号,介导受体内吞。
TFR1的核心功能是介导细胞对铁的摄取。
结合:在细胞外,TFR1与携带两个铁离子的转铁蛋白 高亲和力结合。
内吞:TFR1-Tf-Fe复合物通过网格蛋白介导的内吞作用 被摄入细胞,形成内吞体。
酸化:内吞体内部酸化(pH降低),导致转铁蛋白的构象改变,释放出铁离子。
铁利用与循环:释放的铁被还原后,通过DMT1转运蛋白进入胞质,用于各种生理过程(如血红蛋白合成、能量代谢)。脱铁的转铁蛋白(载铁蛋白)仍然与TFR1结合,整个复合物被循环回细胞表面。
释放与再利用:在细胞表面的中性pH环境下,载铁蛋白与TFR1解离,从而可以再次结合新的铁离子,开始新一轮循环。
调控:TFR1的表达受细胞内铁水平的精密调控。当铁充足时,铁调节蛋白与TFR1 mRNA的铁反应元件结合,促进其降解,减少TFR1的合成。当铁缺乏时,这种降解被抑制,TFR1表达上调。
表达分布
正常组织:在所有需要铁的细胞中均有基础表达,尤其在高增殖性细胞中表达水平很高。
红细胞前体细胞:用于合成血红蛋白。
活化的免疫细胞(T细胞、B细胞):支持其快速增殖和功能。
肝细胞:参与铁的储存和代谢。
胎盘滋养层细胞:负责母体向胎儿的铁转运。
病理组织(特别是肿瘤):
在多种恶性肿瘤中,TFR1的表达显著上调,以满足癌细胞快速增殖和代谢对铁的巨大需求。这包括肝癌、肺癌、乳腺癌、胶质母细胞瘤、胰腺癌等。这使得TFR1成为肿瘤的一个通用标志物。
TFR1作为理想的治疗靶点,主要基于以下几点特征:
高特异性:在癌细胞表面高表达,而在大多数正常成年细胞表面表达较低。
可及性:位于细胞膜表面,便于抗体或药物偶联物接触。
高效内化:能够将与其结合的分子快速内化到细胞内,这对于递送细胞毒性药物至关重要。
现阶段主要的靶向策略包括:
1.抗体偶联药物
这是最主流的策略。将靶向TFR1的单克隆抗体与强效细胞毒性药物(如美登素、卡奇霉素等)通过连接子偶联。
作用机制:ADC通过抗体部分特异性结合癌细胞表面的TFR1,随后被内吞进入细胞。在溶酶体中,细胞毒性药物被释放,杀死癌细胞。
2.双特异性抗体
构建一个同时结合TFR1和T细胞表面抗原(如CD3)的双特异性抗体。
作用机制:将T细胞重定向到癌细胞附近,激活T细胞对癌细胞的杀伤作用。
3.CAR-T细胞疗法
将识别TFR1的抗体片段(scFv)嵌入到CAR(嵌合抗原受体)的结构中,改造T细胞。
作用机制:这些CAR-T细胞能够特异性识别并清除表达TFR1的肿瘤细胞。
4.siRNA/基因沉默疗法
利用纳米颗粒递送靶向TFRC基因的siRNA,在mRNA水平上敲低TFR1的表达,从而剥夺癌细胞的铁供应,抑制其生长。
5.药物递送系统
利用TFR1介导的内吞作用,将TFR1的配体(如转铁蛋白本身或其模拟肽)连接到脂质体或纳米颗粒上,用于递送化疗药物、基因治疗载体或成像剂穿越生物屏障(如血脑屏障),用于治疗脑部疾病。
项目名称
TFR1特异性单克隆抗体
项目亮点
合作模式
序列授权
合作开发
数据展示
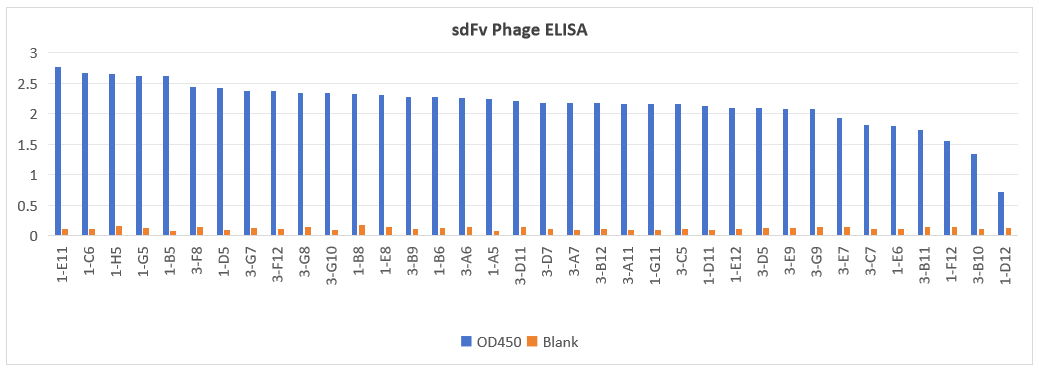
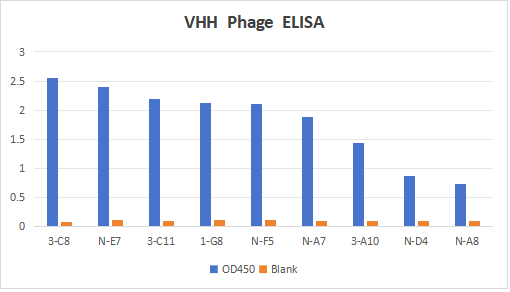
本项目目前筛选到VHH,SdFv等多种类型分子。部分数据如下:
总结分析
该项目共现筛选出多种特异性结合分子共40+序列。
更多检测数据进一步深入开发中。