

千靶万抗:全人源纳米抗体VH抗聚集双特征:二硫键与酸性pI
本研究利用噬菌体展示技术与瞬时热变性筛选法,从一个预置CDR3二硫键的库中,成功富集到可逆折叠且抗聚集的VH。这些优质VH普遍具备两个关键结构特征:一是在CDR1与CDR3之间或内部形成了非经典的二硫键;二是其理论等电点呈酸性(pI < 6)。这为优化人工单域抗体提供了两条明确思路:引入CDR区二硫键与降低等电点。相关名词有:二硫键环、等电点、抗聚集VH 、噬菌体展示和筛选、单域抗体。获得低免疫原性的全人源单域抗体,其核心挑战在于克服VH域的易聚集性。本研究富集到的优质VH均具备特征:CDR区二硫键与酸性等电点,与骆驼、鲨鱼天然单域抗体的进化策略一致。
了解详情
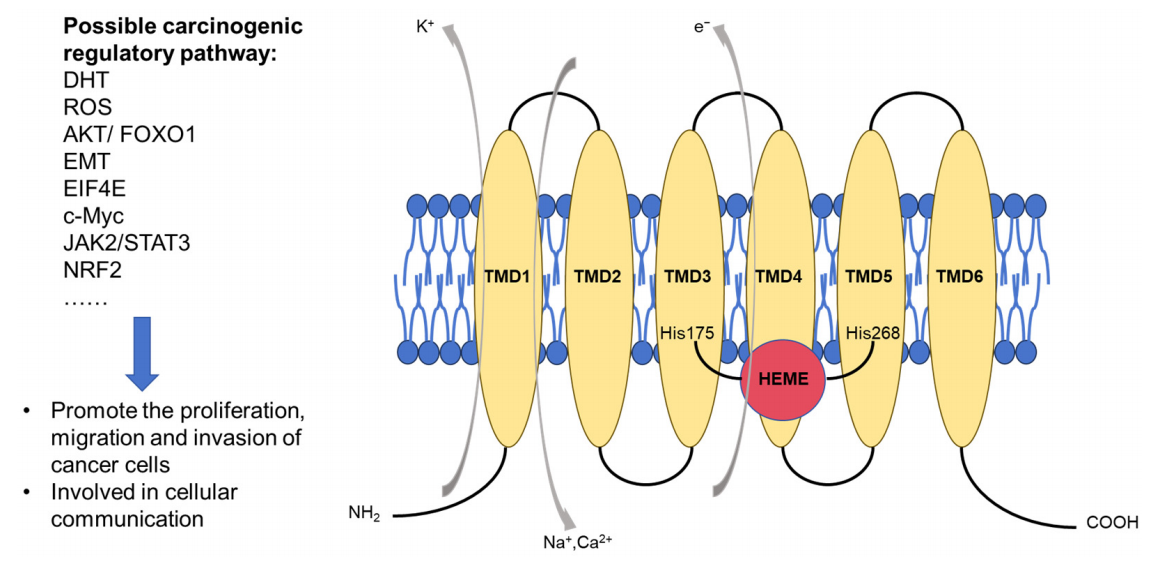
靶点STEAP1:在前列腺癌诊疗中的重要作用和进展!
六次跨膜前列腺上皮抗原1(STEAP1)是一种在PCa和mCRPC中持续高表达的理想靶点。然而,其复杂的多次跨膜结构曾让传统小分子与抗体药物难以有效靶向。近年来,得益于结构生物学及药物研发技术的进步,这一困境得以破局,针对STEAP1的多种创新疗法(如ADC、CAR-T、TCE和疫苗)正蓬勃发展,显示出广阔前景。
了解详情

自免的CAR-T治疗:In vivo与Ex vivo双轨并行!
体内CAR T技术(通过靶向脂质纳米颗粒或慢病毒载体直接体内改造T细胞)可能解决这些问题,但其在自身免疫病中的安全性与有效性尚不明确。研究采用的是MB-CART19.1,这是一种自体来源的、通过慢病毒转导在体外制备的CD19 CAR T细胞产品,还有采用HN2301,一种靶向CD8+T细胞的脂质纳米颗粒(LNP),其内部封装了可编码靶向CD19蛋白的CAR的mRNA。
了解详情
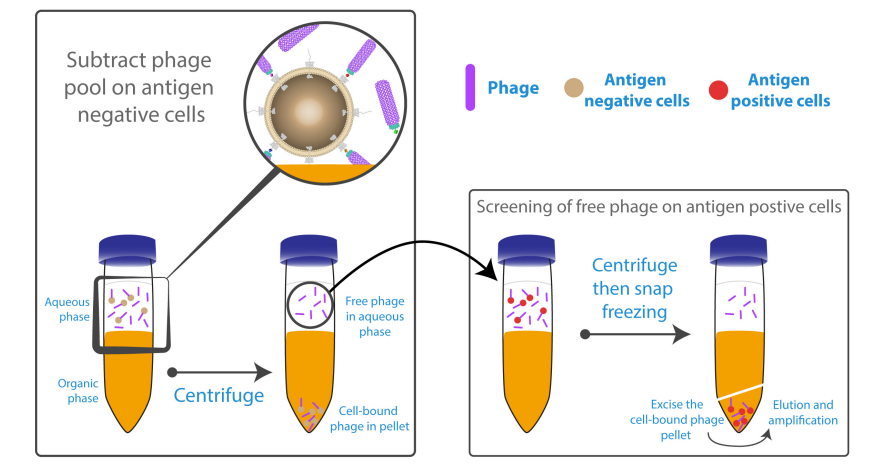
噬菌体展示技术:膜蛋白抗体的细胞筛选法!
膜蛋白(如GPCRs、离子通道)是关键治疗靶点,但其固有的疏水性与结构不稳定性使得传统基于纯化蛋白的筛选策略面临巨大挑战:纯化过程易导致蛋白变性、构象失真,从而筛选出无法识别天然表位的无效抗体。本研究采用基于完整细胞的筛选策略,保持膜蛋白天然构象和修饰,确保抗体功能相关性。预实验针对TLR2表明,传统策略无效,而细胞筛选成功分离出8个具天然活性的克隆,验证了平台有效性。
了解详情
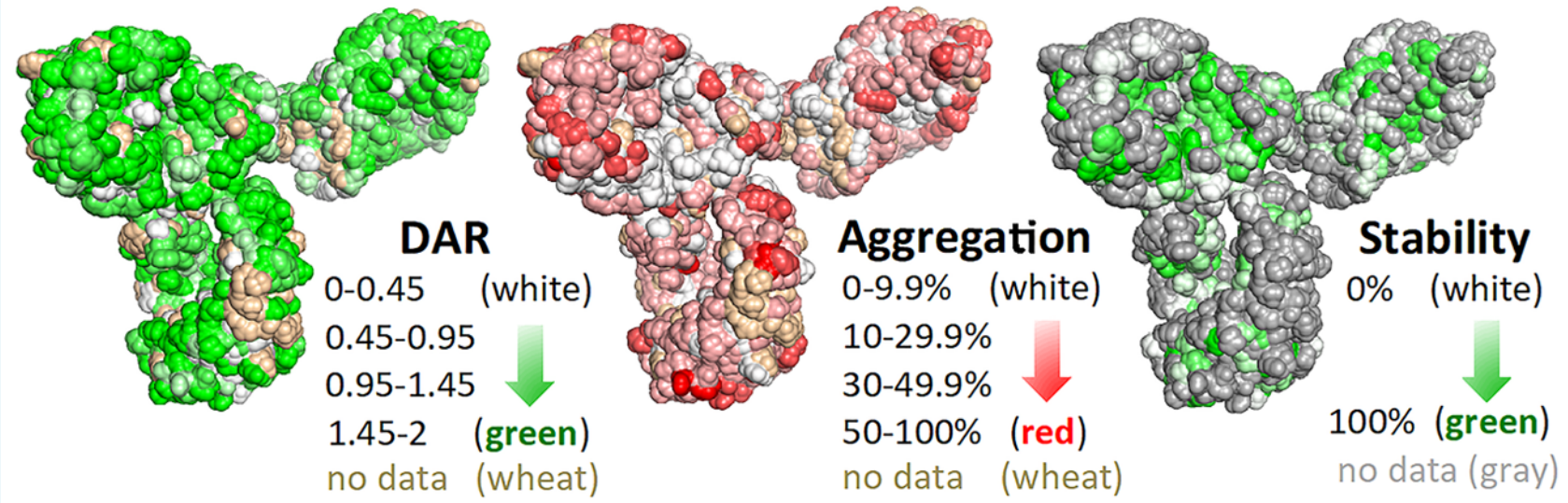
偶联的“命门”所在:如何让药物在抵达目标前不“掉链子”
本研究通过高通量半胱氨酸扫描,系统评估了曲妥珠单抗648个单点Cys突变体与两类ADC连接子(马来酰亚胺vs二硫键)的血浆稳定性。约50%的突变体实现高效偶联(DAR>0.5、聚集<50%),并锁定38个对两类连接子均>80%稳定的位点。结果证实:偶联位点决定连接稳定性,且该稳定性可跨抗体、跨载荷、跨物种保持一致。参考文献:High-Throughput Cysteine Scanning To Identify Stable Antibody Conjugation Sites for Maleimide- and Disulfide-Based Linkers.
了解详情

聚力研发,千靶万抗:成都古格尔生物2025年中团建活动圆满结束!
为增强团队凝聚力、缓解工作压力,感谢大家一直以来的辛苦付出和努力拼搏,成都古格尔生物于2025年08月19日-22日组织了“聚力研发,千靶万抗”主题团建活动,公司全体成员参与。此次团建不仅让大家在户外放松了身心,更重要的是强化了“目标一致、彼此信任,聚力研发”的团队意识。活动后,成员们通过团队协作更直观地感受到了沟通与配合的重要性,未来将把这种团队精神融入工作,提升公司整体效率。
了解详情
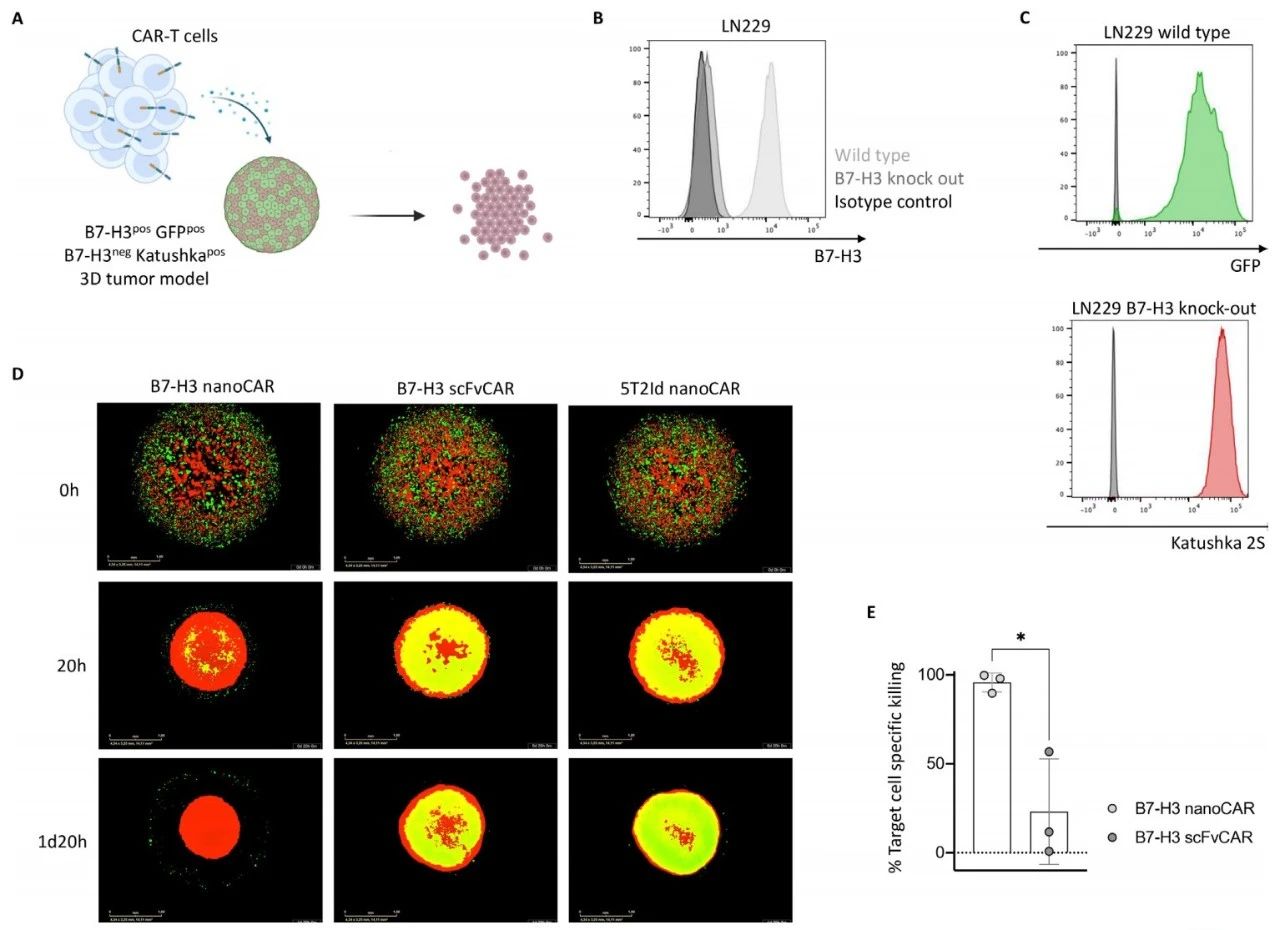
B7-H3纳米抗体:CAR-T细胞从体外活性到体内毒性的全面评估
(胶质母细胞瘤(Glioblastoma Multiforme,GBM)是最常见的致命性原发性脑肿瘤,亟需新疗法。靶向B7同源物3(B7-H3)的嵌合抗原受体T细胞(CAR-T)具有潜力,因B7-H3在肿瘤中高表达而在正常脑组织中低表达。相比传统scFv CAR,纳米抗体CAR(nano CAR)因结构简单、免疫原性低而受关注,但B7-H3 纳米抗体CAR-T在胶质瘤中的研究仍有限。
了解详情
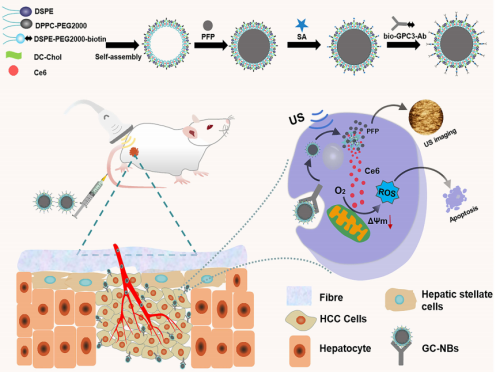
靶向GPC3的超声响应纳米载药系统:肝癌可视化治疗与声敏剂递送
本研究开发了一种靶向磷脂酰肌醇蛋白聚糖-3(GPC3)的纳米递送系统(GC-NBs),结合声动力疗法(SDT)用于肝细胞癌(HCC)的可视化治疗。GC-NBs通过GPC3抗体(GPC3-Ab)主动靶向HCC细胞,并在低强度超声辐照下通过全氟戊烷(PFP)的液气相变实现超声成像。同时,纳米气泡破裂后释放的氯e6(Ce6)在超声作用下产生活性氧(ROS),诱导SDT效应。体外和体内实验表明,GC-NBs能有效富集于肿瘤区域,并在GPC3-Ab引导下实现声动力抗肿瘤治疗。该系统生物毒性低,且可通过超声成像实时监测治疗效果,为HCC治疗提供了新型靶向可视化策略。
了解详情
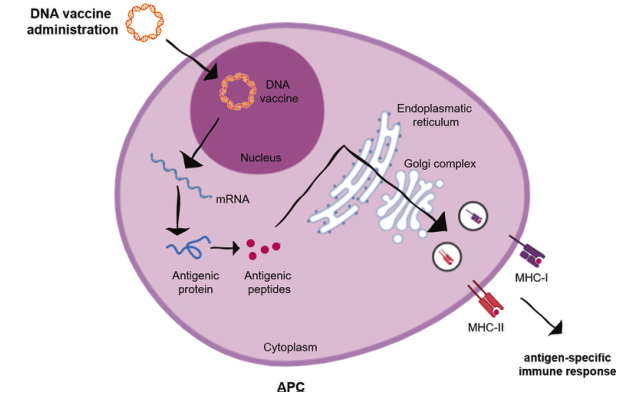
DNA 疫苗作为抗癌免疫药物的希望:一种创新视角!
DNA癌症疫苗是一种新兴的免疫治疗策略,通过质粒载体递送编码肿瘤相关抗原(TAAs)或肿瘤特异性抗原(TSAs)的基因。质粒被宿主细胞(如抗原呈递细胞APCs)摄取后,表达肿瘤抗原并呈递至MHC分子,激活T细胞(尤其是CD8+细胞毒性T细胞)识别并杀伤癌细胞。其核心优势在于安全性高、耐受性好、稳定性强、易于大规模生产、成本效益显著、储运便捷,并能诱导全身性免疫反应对抗原发灶和转移灶。然而,主要挑战是免疫原性较弱。当前研究聚焦于质粒结构优化(如启动子选择、密码子优化、表位增强、整合佐剂/异种或新抗原)、创新递送技术(如电穿孔、无针注射、基因枪、特定注射途径)、与其他疗法(化疗、放疗、免疫检查点抑制剂ICB、细胞因子、激素治疗)联合应用,以克服肿瘤免疫抑制微环境(TME)和免疫耐受,提升临床疗效。DNA疫苗,尤其是靶向新抗原的个性化疫苗,代表了个性化癌症免疫治疗的重大希望。
了解详情
CAR-M与PD1阻断剂联合可增强对HER2+阳性实体瘤的疗效!
嵌合抗原受体T细胞(CAR-T)已经在血液系统恶性肿瘤中显示出显著疗效,但其实体瘤治疗效果仍然有限。作者先前开发了人源嵌合抗原受体巨噬细胞(CAR-M),并证明了其在免疫缺陷异种移植模型中能够重定向巨噬细胞的抗肿瘤功能,从而实现肿瘤控制。在此,作者建立了具有临床相关性的、完全免疫健全的同基因模型,以评估CAR-M重塑肿瘤微环境(TME)、诱导T细胞抗肿瘤免疫以及使实体瘤对抗PD1/PDL1检查点抑制敏感化的潜力。在体内实验中,抗HER2 CAR-M能显著降低肿瘤负荷、延长生存期、重塑TME、增加瘤内T细胞和自然杀伤(NK)细胞浸润,并诱导抗原扩散。
了解详情